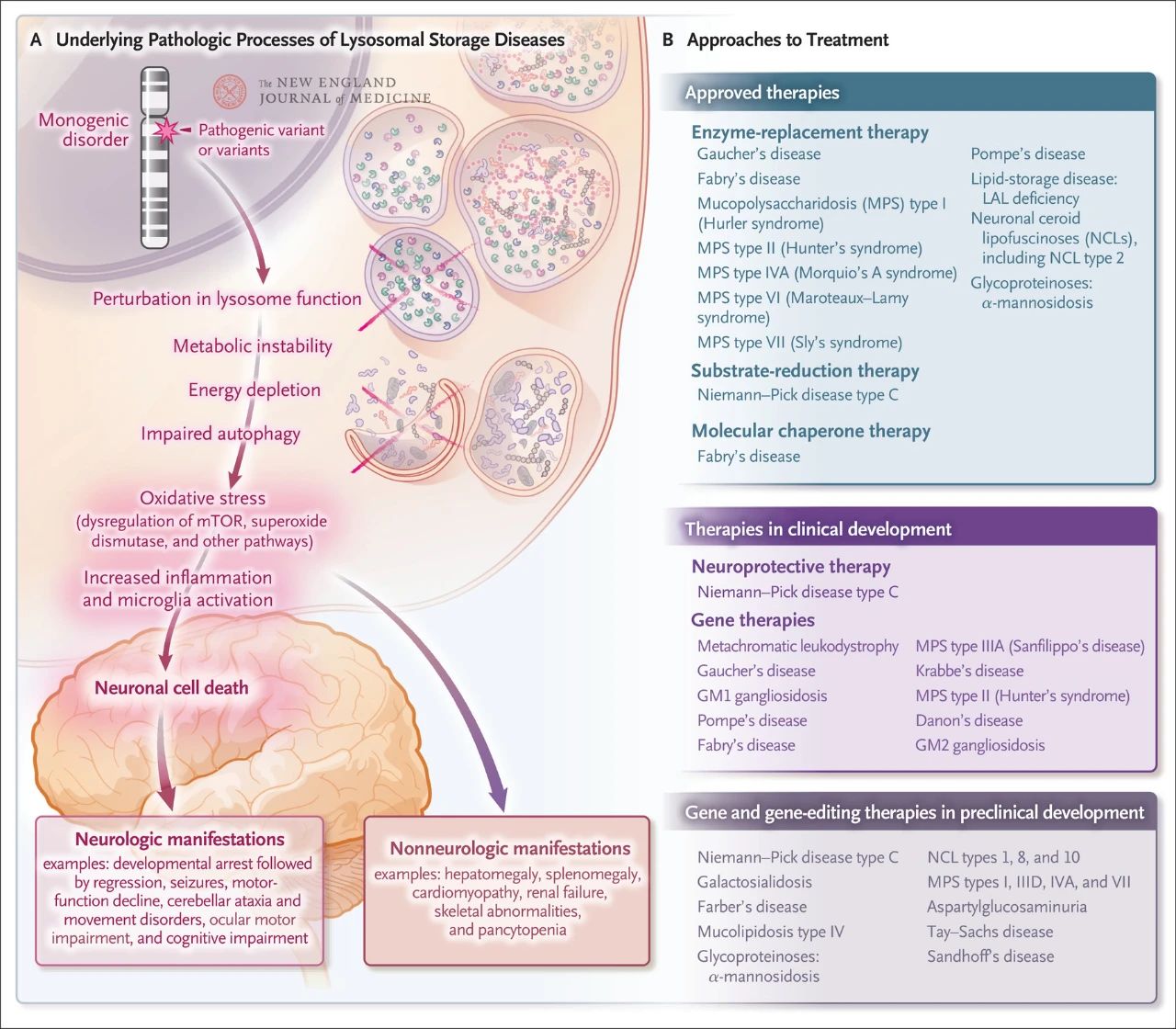
Kuigi lüsosomaalse salvestuse üldine esinemissagedus on suhteliselt haruldane, on see umbes 1 iga 5000 elussünni kohta. Lisaks mõjutavad ligi 70 teadaolevast lüsosomaalsest salvestushaigusest 70% kesknärvisüsteemi. Need ühe geeni häired põhjustavad lüsosomaalset düsfunktsiooni, mille tulemuseks on metaboolne ebastabiilsus, imetajate sihtvalgu rapamütsiini (mTOR, mis tavaliselt pärsib põletikku) düsregulatsioon, autofaagia häired ja närvirakkude surm. Heaks on kiidetud või väljatöötamisel on mitu ravi, mis on suunatud lüsosomaalse salvestushaiguse aluseks olevate patoloogiliste mehhanismide vastu, sealhulgas ensüümisendusravi, substraadi redutseerimise ravi, molekulaarne šaperonravi, geeniteraapia, geenide redigeerimine ja neuroprotektiivne ravi.
Niemann-Picki tõve C-tüüp on lüsosomaalne kolesterooli transpordihäire, mille põhjustavad kas NPC1 (95%) või NPC2 (5%) bialleelsed mutatsioonid. Niemann-Picki tõve C-tüübi sümptomite hulka kuulub kiire ja surmaga lõppev neuroloogiline langus imikueas, samas kui hilise juveniilse, juveniilse ja täiskasvanuea vormide hulka kuuluvad splenomegaalia, supranukleaarne pilgu halvatus ja väikeaju ataksia, düsartikulatsioon ja progresseeruv dementsus.
Selles ajakirja numbris avaldavad Bremova-Ertl jt topeltpimeda, platseebokontrolliga ristuva uuringu tulemused. Uuringus kasutati potentsiaalset neuroprotektiivset ainet, aminohappe analoogi N-atsetüül-L-leutsiini (NALL), Niemann-Picki tõve C-tüübi raviks. Uuringusse kaasati 60 sümptomaatilist noorukit ja täiskasvanud patsienti ning tulemused näitasid ataksia hindamisskaala koguskoori (esmane tulemusnäitaja) olulist paranemist.
N-atsetüül-DL-leutsiini (Tanganil), NALL-i ja n-atsetüül-D-leutsiini ratseemilise ühendi, kliinilised uuringud näivad olevat suuresti kogemusest tingitud: toimemehhanismi pole veel selgelt selgitatud. N-atsetüül-dl-leutsiin on ägeda peapöörituse raviks heaks kiidetud alates 1950. aastatest; loommudelid näitavad, et ravim toimib mediaalsete vestibulaarsete neuronite ülepolarisatsiooni ja depolarisatsiooni tasakaalustamise teel. Seejärel avaldasid Strupp jt lühiajalise uuringu tulemused, milles nad täheldasid sümptomite paranemist 13 erineva etioloogiaga degeneratiivse väikeaju ataksiaga patsiendil, mis äratas taas huvi ravimi uuesti uurimise vastu.
Mehhanism, mille abil n-atsetüül-DL-leutsiin parandab närvifunktsiooni, ei ole veel selge, kuid kahe hiiremudeli – üks Niemann-Picki tõve C-tüübi ja teine GM2 gangliosiidide salvestushäire variandi O (Sandhoffi tõbi), mis on samuti neurodegeneratiivne lüsosomaalne haigus – tulemused on pannud tähelepanu pöörama NALL-ile. Täpsemalt, n-atsetüül-DL-leutsiini või NALL-iga (L-enantiomeerid) ravitud Npc1-/- hiirte elulemus paranes, samas kui n-atsetüül-D-leutsiiniga (D-enantiomeerid) ravitud hiirte elulemus seda ei teinud, mis viitab sellele, et NALL on ravimi aktiivne vorm. Sarnases GM2 gangliosiidide salvestushäire variandi O (Hexb-/-) uuringus pikendas n-atsetüül-DL-leutsiin hiirte eluiga mõõdukalt, kuid märkimisväärselt.
N-atsetüül-DL-leutsiini toimemehhanismi uurimiseks analüüsisid teadlased leutsiini ainevahetusrada, mõõtes metaboliite mutantsete loomade väikeaju kudedes. GM2 gangliosiidide ladustushäire variandi O mudelis normaliseerib n-atsetüül-DL-leutsiin glükoosi ja glutamaadi metabolismi, suurendab autofaagiat ja suurendab superoksiiddismutaasi (aktiivse hapniku püüdja) taset. Niemann-Picki tõve C mudelis täheldati muutusi glükoosi ja antioksüdantide metabolismis ning mitokondriaalse energia metabolismi paranemist. Kuigi L-leutsiin on tugev mTOR-i aktivaator, ei täheldatud mTOR-i tasemes ega fosforüülimises muutusi pärast ravi n-atsetüül-DL-leutsiini või selle enantiomeeridega kummaski hiiremudelis.
NALL-i neuroprotektiivset toimet on täheldatud ajukoore kokkupõrke tagajärjel tekkinud ajukahjustuse hiiremudelis. Nende toimete hulka kuuluvad neuroinflammatoorsete markerite alanemine, ajukoore rakkude surma vähendamine ja autofaagiavoo paranemine. Pärast NALL-ravi taastusid vigastatud hiirte motoorsed ja kognitiivsed funktsioonid ning kahjustuse suurus vähenes.
Kesknärvisüsteemi põletikuline reaktsioon on enamiku neurodegeneratiivsete lüsosomaalsete salvestushaiguste tunnusjoon. Kui neuroinflammatsiooni saab NALL-raviga vähendada, võivad paljude, kui mitte kõigi neurodegeneratiivsete lüsosomaalsete salvestushaiguste kliinilised sümptomid leeveneda. Nagu see uuring näitab, eeldatakse, et NALL-il on sünergia ka teiste lüsosomaalse salvestushaiguse ravimeetoditega.
Paljud lüsosomaalsed salvestushäired on seotud ka väikeaju ataksiaga. Rahvusvahelise uuringu kohaselt, milles osalesid GM2 gangliosiidide salvestushäiretega (Tay-Sachsi tõbi ja Sandhoffi tõbi) lapsed ja täiskasvanud, vähenes ataksia ja paranes peenmotoorika koordinatsioon pärast NALL-ravi. Suur, mitmekeskuseline, topeltpime, randomiseeritud, platseebokontrolliga uuring näitas aga, et n-atsetüül-DL-leutsiin ei olnud kliiniliselt efektiivne segatüüpi (päriliku, mittepäriliku ja seletamatu) väikeaju ataksiaga patsientidel. See leid viitab sellele, et efektiivsust võidakse täheldada ainult uuringutes, milles osalevad päriliku väikeaju ataksiaga patsiendid, ja analüüsitakse sellega seotud toimemehhanisme. Lisaks, kuna NALL vähendab neuroinflammatsiooni, mis võib viia traumaatilisse ajukahjustuseni, võib kaaluda NALL-i uuringuid traumaatilise ajukahjustuse raviks.
Postituse aeg: 02.03.2024