Nosokomiaalne kopsupõletik on kõige levinum ja tõsisem nosokomiaalne infektsioon, millest ventilaatoriga seotud kopsupõletik (VAP) moodustab 40%. Refraktaarsete patogeenide põhjustatud VAP on endiselt keeruline kliiniline probleem. Aastaid on juhised soovitanud VAP-i ennetamiseks mitmesuguseid sekkumisi (näiteks sihipärane sedatsioon, pea ülestõstmine), kuid VAP esineb kuni 40%-l trahhea intubatsiooniga patsientidest, mille tulemuseks on pikem haiglas viibimine, antibiootikumide suurenenud kasutamine ja surm. Inimesed otsivad alati tõhusamaid ennetusmeetmeid.
Ventilaatoriga seotud kopsupõletik (VAP) on uus kopsupõletiku vorm, mis tekib 48 tundi pärast trahhea intubatsiooni ning on intensiivraviosakonnas (ICU) kõige levinum ja surmavam nozokomiaalne infektsioon. Ameerika Nakkushaiguste Ühingu 2016. aasta suunistes on VAP eristatud haiglatekkese kopsupõletiku (HAP) definitsioonist (HAP viitab ainult kopsupõletikule, mis tekib pärast haiglaravi ilma trahheatoruta ja ei ole seotud mehaanilise ventilatsiooniga; VAP on kopsupõletik pärast trahhea intubatsiooni ja mehaanilist ventilatsiooni) ning Euroopa Ühing ja Hiina usuvad, et VAP on endiselt HAP-i eriliik [1-3].
Mehaanilist ventilatsiooni saavatel patsientidel on VAP-i esinemissagedus vahemikus 9% kuni 27%, suremus on hinnanguliselt 13% ning see võib viia süsteemse antibiootikumide kasutamise suurenemiseni, pikaajalise mehaanilise ventilatsioonini, pikaajalise intensiivravi osakonnas viibimiseni ja suurenenud kuludeni [4-6]. HAP/VAP-i põhjustab immuunpuudulikkuseta patsientidel tavaliselt bakteriaalne infektsioon ning levinud patogeenide levik ja nende resistentsusomadused varieeruvad piirkonniti, haigla klassis, patsientide populatsioonis ja antibiootikumidega kokkupuutes ning muutuvad aja jooksul. Pseudomonas aeruginosa domineeris VAP-iga seotud patogeenides Euroopas ja Ameerikas, samas kui Hiinas isoleeriti rohkem Acinetobacter baumannii'd tertsiaarhaiglates. Kolmandik kuni pool kõigist VAP-iga seotud surmajuhtumitest on otseselt põhjustatud infektsioonist, kusjuures Pseudomonas aeruginosa ja acinetobacteri põhjustatud juhtude suremus on kõrgem [7,8].
VAP-i tugeva heterogeensuse tõttu on selle kliiniliste ilmingute, pildiuuringute ja laboratoorsete testide diagnostiline spetsiifilisus madal ning diferentsiaaldiagnostika ulatus lai, mis raskendab VAP-i õigeaegset diagnoosimist. Samal ajal tekitab bakteriaalne resistentsus VAP-i ravis tõsise väljakutse. Hinnanguliselt on VAP-i tekkerisk mehaanilise ventilatsiooni esimese 5 päeva jooksul 3% päevas, 5.–10. päeva jooksul 2% päevas ja ülejäänud aja jooksul 1% päevas. Maksimaalne esinemissagedus saabub üldiselt pärast 7-päevast ventilatsiooni, seega on olemas aken, mille jooksul saab infektsiooni varakult ennetada [9,10]. Paljud uuringud on uurinud VAP-i ennetamist, kuid vaatamata aastakümneid kestnud uuringutele ja katsetele VAP-i ennetada (näiteks intubatsiooni vältimine, reintubatsiooni vältimine, sedatsiooni vähendamine, voodipeatsi tõstmine 30°–45° ja suuhügieen) ei tundu esinemissagedus olevat vähenenud ja sellega kaasnev meditsiiniline koormus on endiselt väga suur.
Inhaleeritavaid antibiootikume on krooniliste hingamisteede infektsioonide raviks kasutatud alates 1940. aastatest. Kuna see suudab maksimeerida ravimite kohaletoimetamist infektsiooni sihtkohta (st hingamisteedesse) ja vähendada süsteemseid kõrvaltoimeid, on see näidanud head rakendusväärtust mitmesuguste haiguste korral. Inhaleeritavad antibiootikumid on nüüdseks heaks kiidetud USA Toidu- ja Ravimiameti (FDA) ja Euroopa Ravimiameti (EMA) poolt tsüstilise fibroosi raviks. Inhaleeritavad antibiootikumid võivad oluliselt vähendada bakterite hulka ja bronhektaasia ägenemiste sagedust, suurendamata üldiseid kõrvaltoimeid, ning praegused juhised on tunnustanud neid esmavaliku ravina pseudomonas aeruginosa infektsiooni ja sagedaste ägenemistega patsientidele; Inhaleeritavaid antibiootikume kopsusiirdamise perioperatiivsel perioodil saab kasutada ka adjuvantide või profülaktiliste ravimitena [11,12]. Kuid 2016. aasta USA VAP-i juhistes puudus ekspertidel usk adjuvantide inhaleeritavate antibiootikumide efektiivsusesse suurte randomiseeritud kontrollitud uuringute puudumise tõttu. 2020. aastal avaldatud 3. faasi uuring (INHALE) ei andnud samuti positiivseid tulemusi (amikatsiiniga toetatud intravenoossete antibiootikumide inhaleerimine VAP-patsientide põhjustatud gramnegatiivsete bakterite infektsiooni korral, topeltpime, randomiseeritud, platseebokontrolliga 3. faasi efektiivsusuuring, kokku 807 patsienti, süsteemne ravim + amikatsiini abistatud inhalatsioon 10 päeva jooksul).
Selles kontekstis võttis Prantsusmaa Toursi regionaalülikoolihaigla keskuse (CHRU) teadlaste juhitud meeskond kasutusele teistsuguse uurimisstrateegia ja viis läbi uurija algatatud mitmekeskuselise topeltpimeda randomiseeritud kontrollitud efektiivsusuuringu (AMIKINHAL). Inhaleeritavat amikatsiini ja platseebot VAP-i ennetamisel võrreldi 19 Prantsusmaa intensiivravi osakonna patsiendil [13].
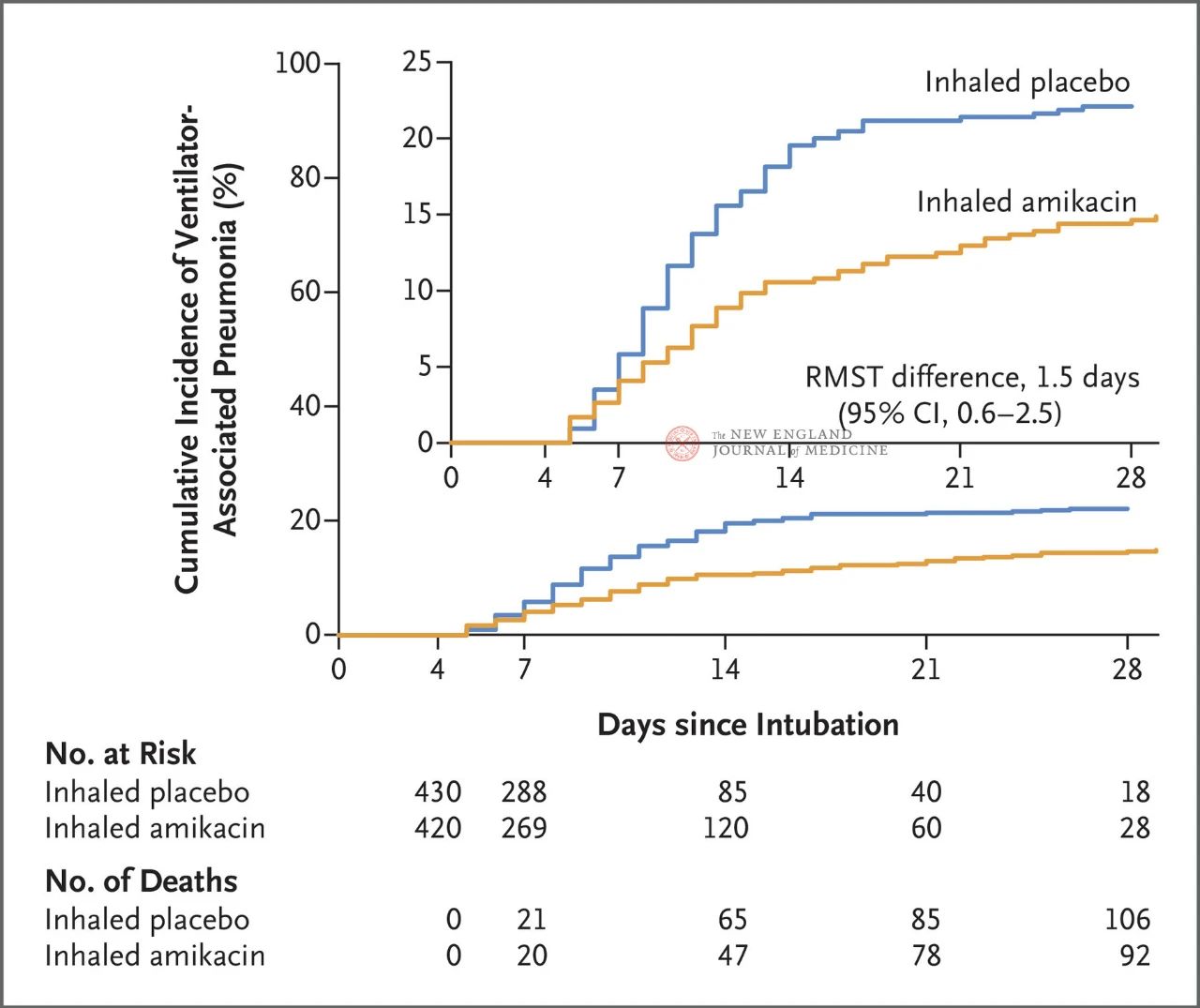
Kokku 847 täiskasvanud patsienti, kellel oli 72 kuni 96 tunni jooksul tehtud invasiivne mehaaniline ventilatsioon, määrati randomiseeritult suhtega 1:1 kolmeks päevaks amikatsiini inhalatsiooni (N = 417,20 mg/kg ideaalse kehakaalu kohta, üks kord päevas) või platseebo inhalatsiooni (N = 430, 0,9% naatriumkloriidi ekvivalent) rühmadesse. Esmane tulemusnäitaja oli esimene VAP-i episood randomiseeritud määramise algusest kuni 28. päevani.
Uuringu tulemused näitasid, et 28. päevaks oli amikatsiinirühmas 62 patsiendil (15%) ja platseeborühmas 95 patsiendil (22%) tekkinud VAP (VAP-i keskmine elulemuse erinevus oli 1,5 päeva; 95% CI, 0,6–2,5; P = 0,004).
Ohutuse osas esines uuringuga seotud tõsiseid kõrvaltoimeid seitsmel patsiendil (1,7%) amikatsiinirühmas ja neljal patsiendil (0,9%) platseeborühmas. Nende seas, kellel randomiseerimisel ägedat neerukahjustust ei olnud, oli 28. päeval äge neerukahjustus 11 patsiendil (4%) amikatsiinirühmas ja 24 patsiendil (8%) platseeborühmas (HR, 0,47; 95% CI, 0,23–0,96).
Kliinilisel uuringul oli kolm olulist aspekti. Esiteks, uuringu ülesehituse osas tugineb AMIKINHAL uuring IASIS uuringule (randomiseeritud, topeltpime, platseebokontrolliga, paralleelne II faasi uuring, milles osales 143 patsienti). Amikatsiini-fosfomütsiini inhalatsiooni ohutuse ja efektiivsuse hindamiseks gramnegatiivsete bakterite põhjustatud infektsiooni süsteemse ravi korral VAP-i puhul ning INHALE uuringu negatiivsete tulemustega lõpetamiseks on saadud õppetunde, mis keskenduvad VAP-i ennetamisele ja annavad suhteliselt häid tulemusi. Mehaanilise ventilatsiooni ja VAP-iga patsientide kõrge suremuse ja pika haiglas viibimise tõttu on amikatsiini inhalatsiooniga saavutatavad tulemused surma ja haiglas viibimise vähendamisel kliinilises praktikas väärtuslikumad. Arvestades aga iga patsiendi ja iga keskuse hilise ravi ja hoolduse heterogeensust, on mitmeid segavaid tegureid, mis võivad uuringut segada, mistõttu võib olla keeruline saada ka inhaleeritavate antibiootikumide tõttu positiivset tulemust. Seetõttu nõuab edukas kliiniline uuring lisaks suurepärasele uuringu ülesehitusele ka sobivate esmaste tulemusnäitajate valimist.
Teiseks, kuigi aminoglükosiidantibiootikume ei soovitata erinevates VAP-i suunistes üksi ravimina, võivad aminoglükosiidantibiootikumid katta VAP-i patsientidel esinevaid tavalisi patogeene (sealhulgas pseudomonas aeruginosa, acinetobacter jne) ning tänu nende piiratud imendumisele kopsuepiteelirakkudes, kõrgele kontsentratsioonile infektsioonikohas ja madalale süsteemsele toksilisusele. Aminoglükosiidantibiootikumid on inhaleeritavate antibiootikumide seas laialdaselt eelistatud. See artikkel on kooskõlas varem avaldatud põhjaliku hinnanguga gentamütsiini intratrahheaalse manustamise mõju suuruse kohta väikestes valimites, mis ühiselt näitab inhaleeritavate aminoglükosiidantibiootikumide mõju VAP-i ennetamisel. Samuti tuleb märkida, et enamik inhaleeritavate antibiootikumidega seotud uuringutes valitud platseebokontrollidest olid füsioloogiline lahus. Arvestades aga, et füsioloogilise lahusega pihustatud inhalatsioon ise võib mängida teatud rolli röga vedeldamisel ja rögalahtisti toimel, võib füsioloogiline lahus uuringutulemuste analüüsimisel teatud häireid põhjustada, mida tuleks uuringus põhjalikult arvesse võtta.
Lisaks on oluline HAP/VAP-ravimite lokaalne kohandamine, nagu ka antibiootikumprofülaktika. Samal ajal, olenemata intubatsiooniaja pikkusest, on kohaliku intensiivravi osakonna ökoloogia multiresistentsete bakterite nakatumise kõige olulisem riskitegur. Seetõttu peaks empiiriline ravi võimalikult palju tuginema kohalike haiglate mikrobioloogilistele andmetele ega tohiks pimesi viidata suunistele ega tertsiaarhaiglate kogemustele. Samal ajal esineb kriitiliselt haigetel patsientidel, kes vajavad mehaanilist ventilatsiooni, sageli multisüsteemseid haigusi ning mitme teguri, näiteks stressiseisundi koostoimel võib esineda ka soolemikroobide ülekandumine kopsudesse. Sisemise ja välise superpositsiooni põhjustatud haiguste suur heterogeensus määrab ka selle, et iga uue sekkumise ulatuslik kliiniline edendamine on veel pikk tee minna.
Postituse aeg: 02. dets. 2023